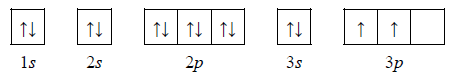
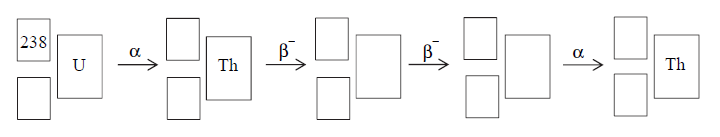
Przemiany promieniotwórcze izotopu uranu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Izotopem uranu najbardziej rozpowszechnionym w przyrodzie jest izotop o liczbie masowej równej 238, z którego w wyniku emisji cząstki α powstaje izotop toru. W kolejnych przemianach, na skutek dwukrotnego rozpadu β–, a następnie – rozpadu α, tworzy się inny izotop toru.
Uzupełnij poniży schemat opisujący przemiany, jakim ulega izotop uranu
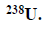
Wpisz w odpowiednie miejsca symbole pierwiastków i ich liczby atomowe i masowe.
Wiązania występujące w cząsteczce amoniaku
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
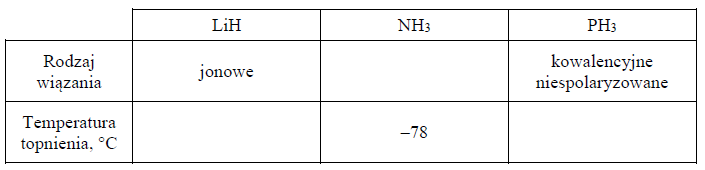
Ustal i wpisz do tabeli, jaki rodzaj wiązania (kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane, jonowe) występuje w cząsteczce NH3. Następnie przyporządkuj dwóm związkom: LiH i PH3, wartości ich temperatury topnienia: 692 °C, –134 °C (pod ciśnieniem 1013 hPa).
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2003.
Kształt cząsteczek siarkowodoru, siarczku węgla, metanu
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Poniżej podano wzory następujących cząsteczek i jonów:
H2S
CS2
CH4
NH+4
CO2
H3O+
Spośród drobin, których wzory podano powyżej, wybierz wszystkie, które odpowiadają opisowi podanemu w tabeli. Napisz ich wzory.

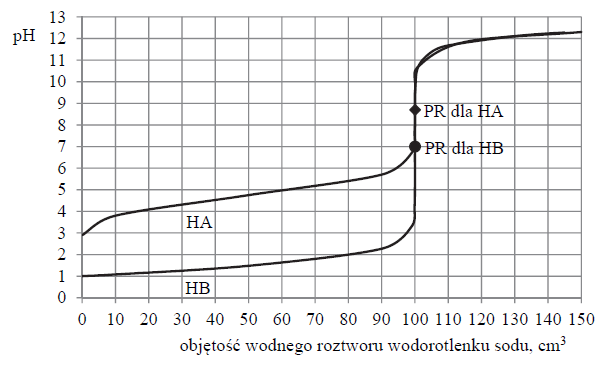
Stała stężeniowa reakcji wody z tlenkiem węgla(IV)
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Stężeniowa stała równowagi reakcji
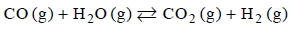
w temperaturze 1000 K jest równa 1.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001.
W reaktorze o stałej pojemności znajdowało się 6 moli tlenku węgla(II).
Oblicz, ile moli wody (w postaci pary wodnej) należy wprowadzić do reaktora, aby po ustaleniu się równowagi w temperaturze 1000 K liczba moli wodoru była dwa razy większa od liczby moli tlenku węgla(II).
Zmieszano w zbiorniku metan z tlenem.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
W zbiorniku o stałej pojemności znajdowały się w pewnych warunkach ciśnienia i temperatury innych niż warunki normalne 2 mole metanu i 2 mole tlenu. Po zainicjowaniu reakcji przebiegła ona zgodnie z równaniem:
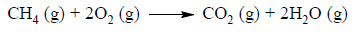
Napisz, w jakim stosunku objętościowym i masowym zmieszano w zbiorniku metan z tlenem. Określ stosunek objętościowy tlenku węgla(IV) i pary wodnej w zbiorniku po zakończeniu reakcji. Stosunek objętościowy i masowy wyraź za pomocą najmniejszych liczb całkowitych.
Stosunek objętościowy V metanu : V tlenu =
Stosunek masowy m metanu : m tlenu =
Stosunek objętościowy V tlenku węgla(IV) : V pary wodnej =
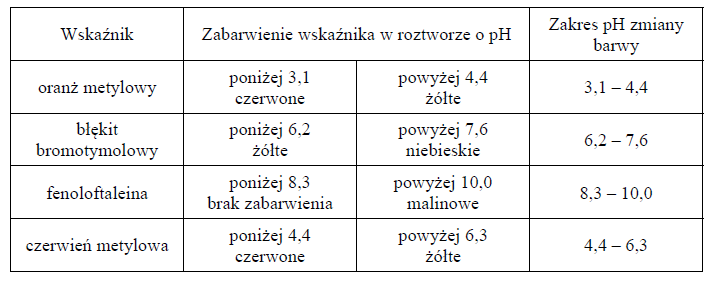
Uporządkowanie gazów pod względem objętości.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Przygotowano próbki następujących gazów: NO2, CH4, NH3, SO2 i O2 o jednakowej masie. Wszystkie gazy znajdują się w tych samych warunkach ciśnienia i temperatury. Przyjmij, że w opisanych warunkach NO2 nie ulega dimeryzacji.
Spośród podanych gazów wybierz i zapisz wzory tych, które po wprowadzeniu do probówek z wodnym roztworem oranżu metylowego spowodują zmianę barwy zawartości probówek.
Uporządkuj próbki gazów zgodnie z ich rosnącą objętością. Napisz wzory gazów w odpowiedniej kolejności.
……………………………………………………………………………………………………
najmniejsza objętość największa objętość
Węglan litu i chlorek sodu – rozpuszczalność
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Wykres rozpuszczalności w wodzie dwóch soli: węglanu litu i chlorku ołowiu(II), w zależności od temperatury przedstawia poniższy wykres.
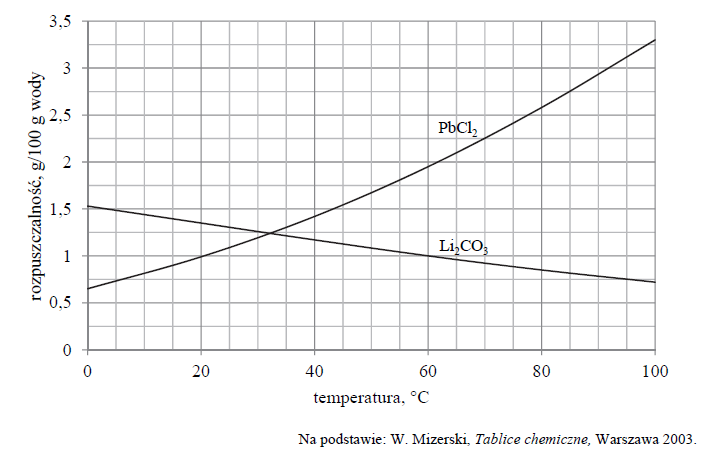
W dwóch zlewkach A i B zmieszano z wodą – odpowiednio – węglan litu oraz chlorek ołowiu(II) i otrzymano mieszaniny o temperaturze 60 ºC. Przebieg doświadczenia zilustrowano na poniższym schemacie.
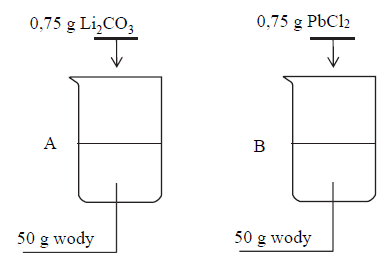
Napisz oznaczenie zlewki, w której powstał roztwór nienasycony, oraz napisz najwyższą wartość temperatury, poniżej której otrzymano by w tej zlewce roztwór nasycony w równowadze z osadem.
Roztwór nienasycony powstał w zlewce
Otrzymano by roztwór nasycony w temperaturze niższej niż
Obliczanie nierozpuszczonej soli węglanu litu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Wykres rozpuszczalności w wodzie dwóch soli: węglanu litu i chlorku ołowiu(II), w zależności od temperatury przedstawia poniższy wykres.

W dwóch zlewkach A i B zmieszano z wodą – odpowiednio – węglan litu oraz chlorek
ołowiu(II) i otrzymano mieszaniny o temperaturze 60 ºC. Przebieg doświadczenia zilustrowano na poniższym schemacie.

Do zlewki A dolano 20,00 g roztworu Li2CO3 o stężeniu 1% (w procentach masowych) i zawartość zlewki oziębiono do temperatury 30 °C.
Oblicz masę węglanu litu, który pozostanie nierozpuszczony. Wynik podaj w gramach w zaokrągleniu do drugiego miejsca po przecinku.
Marmur, wapno palone, wapno gaszone, gips krystaliczny, krzemionka.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
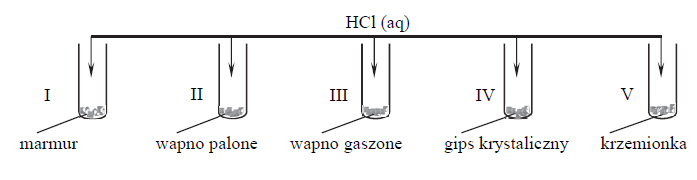
Napisz numery wszystkich probówek, w których zaszły reakcje chemiczne.
Mieszanina gazów: tlenku węgla(IV), amoniaku oraz metanu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Mieszaninę gazów składającą się z tlenku węgla(IV), amoniaku i metanu o objętości 9,78 dm3 przepuszczono w temperaturze 25 °C i pod ciśnieniem 1013 hPa przez płuczki, których zawartość przedstawia poniższy rysunek. Stosunek molowy amoniaku do metanu w wyjściowej mieszaninie był równy 3 : 1. Po przepuszczeniu mieszaniny gazów przez płuczki okazało się, że tylko jeden gaz nie został pochłonięty i opuścił zestaw płuczek.
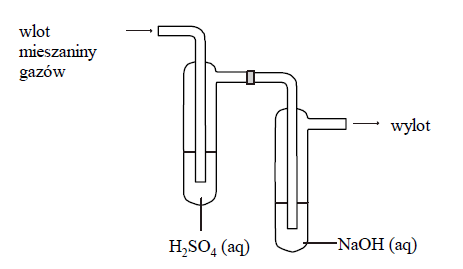
Podczas przepuszczenia gazów przez płuczki, w płuczce z wodnym roztworem wodorotlenku sodu zachodziła reakcja:
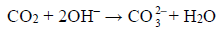
Masa tej płuczki wzrosła o 5,28 g.
Oblicz, jaką objętość zająłby w warunkach normalnych amoniak, który był składnikiem mieszaniny. Uniwersalna stała gazowa R = 83,1 dm3·hPa·mol–1·K–1.
Wzór najsłabszej zasady w teorii Bronsteda powstałej z dysocjacji kwasów chlorowych.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Związek między mocą kwasu Brønsteda i zasady sprzężonej z tym kwasem w roztworach wodnych przedstawia zależność:
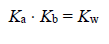
gdzie Ka oznacza stałą dysocjacji kwasu, Kb – stałą dysocjacji sprzężonej zasady, a Kw – iloczyn jonowy wody, którego wartość wynosi
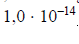
w temperaturze 298 K. W poniższej tabeli podano wartości stałej dysocjacji wybranych kwasów chlorowych w temperaturze 298 K.
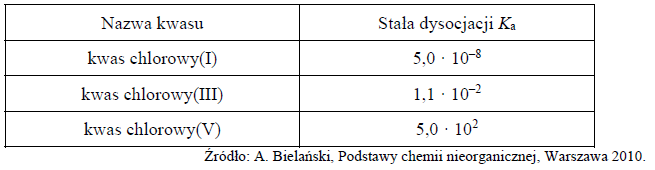
Napisz wzór najsłabszej zasady spośród zasad sprzężonych z kwasami wymienionymi w tabeli.
Wytrącanie kamienia kotłowego po ogrzaniu wody.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Poniżej przedstawiono informacje dotyczące zawartości wybranych jonów w próbce pewnej wody mineralnej.
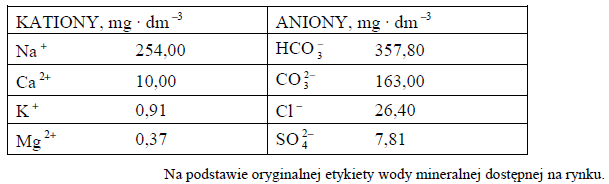
Z przedstawionych informacji wynika, że woda mineralna to roztwór zawierający różne rozpuszczone sole.
Napisz w formie cząsteczkowej równanie reakcji chemicznej, w wyniku której nastąpi wytrącenie osadu – składnika tzw. kamienia kotłowego – po ogrzaniu wody mineralnej do temperatury 100 °C.Napisz w formie cząsteczkowej równanie reakcji chemicznej, w wyniku której nastąpi wytrącenie osadu – składnika tzw. kamienia kotłowego – po ogrzaniu wody mineralnej do temperatury 100 °C.
Spośród wymienionych związków wybierz wszystkie, które – wprowadzone w odpowiednim nadmiarze do wody mineralnej – spowodują usunięcie jonów węglanowych i wodorowęglanowych. Podkreśl wzory wybranych związków.
KHCO3
Ca(OH)2
HCl
KMnO4