Kwas arsenowy(V) H3 AsO4 – kwas trójprotonowy
Arkusz z chemii rozszerzonej maj 2021
Kwas arsenowy(V) H3 AsO4 jest kwasem trójprotonowym o mocy zbliżonej do kwasu ortofosforowego(V). Równowagom, które ustalają się w roztworze wodnym tego kwasu, odpowiadają stałe opisane poniższymi wyrażeniami (podanymi w przypadkowej kolejności), w których została pominięta woda będąca środowiskiem reakcji.
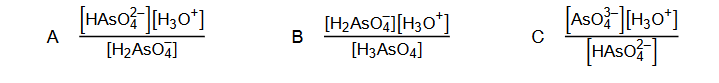
Uszereguj stałe równowagi (wpisz litery A, B oraz C) zgodnie z ich rosnącą wartością. Napisz równanie przemiany, której odpowiada stała równowagi opisana wyrażeniem A. Spośród jonów powstających podczas protolizy (dysocjacji) kwasu arsenowego(V) wybierz i napisz wzór tego, który może pełnić wyłącznie funkcję kwasu Brønsteda.
najmniejsza wartość: – największa wartość:
Równanie reakcji:
Jon, który może pełnić wyłącznie funkcję kwasu Brønsteda:
Kinetyka i statyka chemiczna
Arkusz z chemii rozszerzonej maj 2021
Do 500 cm³ wodnego roztworu kwasu metanowego (mrówkowego) o stężeniu 1 mol ∙ dm⁻³ dodano 500 cm³ wody. Temperatura otrzymanego roztworu nie uległa zmianie.
Dokończ zdanie. Zaznacz odpowiedź wybraną spośród A–C oraz odpowiedź wybraną spośród 1.–3.
Należy wnioskować, że po dodaniu wody do wodnego roztworu kwasu metanowego
Katalizator i jego wpływ na energię aktywacji i wydajność procesu
Arkusz z chemii rozszerzonej marzec 2021
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Działanie katalizatora prowadzi do (obniżenia / podwyższenia) energii aktywacji katalizowanej reakcji. Obecność katalizatora (wpływa / nie wpływa) na wydajność procesu. Katalizatory (zmieniają szybkość / nie zmieniają szybkości), z jaką układ osiąga stan równowagi.
stan równowagi dynamicznej i stała równowagi
Arkusz z chemii rozszerzonej marzec 2021
Poniżej przedstawiono równanie reakcji syntezy amoniaku.
N₂ + 3H₂ ⇄ 2NH₃ Δ𝐻 = – 91,8 kJ
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Wzrost temperatury w układzie reakcyjnym poskutkuje (spadkiem / wzrostem) wydajności syntezy amoniaku. Dodanie do reaktora większej ilości wodoru przyczyni się do (spadku / wzrostu) ilości amoniaku w mieszaninie poreakcyjnej. Obniżenie ciśnienia w układzie reakcyjnym poskutkuje (spadkiem / wzrostem) wydajności syntezy amoniaku.
interpretacja wartości stałej dysocjacji, pH, pKw
Arkusz z chemii rozszerzonej marzec 2021
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm⁻³.
1. Napisz wzory sumaryczne tych soli w kolejności wzrastającego pH ich wodnych roztworów.
2. Napisz w formie jonowej skróconej równanie reakcji zachodzącej w roztworze chlorku amonu.
3. Określ, jaką funkcję (kwasu czy zasady Brønsteda) pełni woda w reakcji zachodzącej w roztworze fluorku sodu.
Przygotowywanie i rozcieńczanie roztworów
Arkusz z chemii rozszerzonej marzec 2021
Odmierzono 10,0 cm³ kwasu solnego o stężeniu c = 10,0% masowych i gęstości d = 1,05 g · cm⁻³ , a następnie rozcieńczono ten kwas wodą destylowaną do objętości 750 cm³ .
Oblicz pH otrzymanego roztworu. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
charakter chemiczny wodorotlenku glinu
Arkusz z chemii rozszerzonej marzec 2021
Poniższy wykres przedstawia zależność rozpuszczalności molowej – czyli stężenia molowego substancji w jej roztworze nasyconym – wodorotlenku glinu od pH roztworu wodnego w temperaturze 25 °C. W tym ujęciu rozpuszczalność związku uwzględniła powstawanie rozpuszczalnych produktów reakcji, jakim ten związek ulega w zależności od pH roztworu.
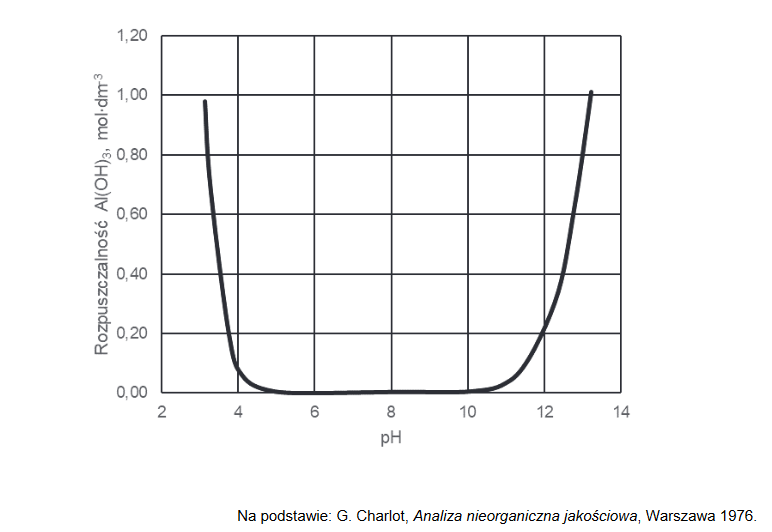
Napisz, jaka właściwość chemiczna wodorotlenku glinu decyduje o zmianach rozpuszczalności tego związku przedstawionych na wykresie. Napisz w formie jonowej skróconej równania reakcji potwierdzające charakter chemiczny wodorotlenku glinu.
Charakter chemiczny:
Równania reakcji:
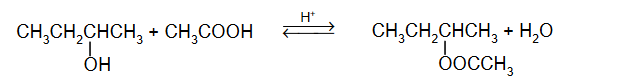
wydajność reakcji estryfikacji
Arkusz z chemii rozszerzonej marzec 2021
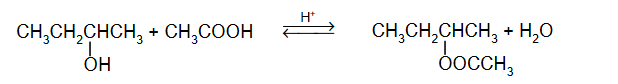
W temperaturze 25 °C do 1 mola kwasu etanowego dodano 1 mol etanolu i uzyskano mieszaninę o objętości V. Do otrzymanej mieszaniny dodano niewielką ilość stężonego kwasu siarkowego(VI). Przebiegła reakcja i w temperaturze 25 °C ustalił się stan równowagi, co zilustrowano równaniem:
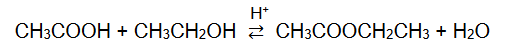
Stężeniowa stała równowagi tej reakcji w temperaturze 25 °C jest równa Kc = 4.
Oblicz wydajność opisanej reakcji estryfikacji w temperaturze 25 °C.
stężenie równowagowe
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
W pewnych warunkach ciśnienia i temperatury w trzech reaktorach (I, II i III) ustalił się stan równowagi reakcji zilustrowanych równaniami:
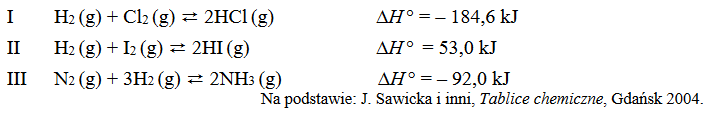
Napisz numer reaktora, w którym pod wpływem wzrostu ciśnienia (T = const) wzrosło stężenie równowagowe odpowiedniego wodorku, oraz numer reaktora, w którym pod wpływem wzrostu temperatury (p = const) wzrosło stężenie równowagowe odpowiedniego wodorku.
Wzrost ciśnienia skutkuje wzrostem stężenia równowagowego wodorku w reaktorze ….. .
Wzrost temperatury skutkuje wzrostem stężenia równowagowego wodorku w reaktorze ….. .
rozpuszczalniki amfiprotycznymi – rozpuszczalniki, których cząsteczki mogą zarówno odszczepiać, jak i przyłączać proton
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Rozpuszczalnikami amfiprotycznymi nazywa się rozpuszczalniki, których cząsteczki mogą zarówno odszczepiać, jak i przyłączać proton. Do rozpuszczalników amfiprotycznych należą m.in. woda, ciekłe alkohole oraz kwasy karboksylowe, ciekły amoniak i aminy.
W rozpuszczalnikach amfiprotycznych ustala się stan równowagi reakcji autoprotolizy, która dla wody zachodzi zgodnie z równaniem:
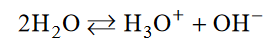
Reakcję autoprotolizy rozpuszczalnika opisuje stała równowagi nazywana iloczynem jonowym rozpuszczalnika, np. iloczyn jonowy wody wyraża się równaniem:
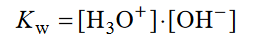
1. Iloczyn jonowy wody w temperaturze 80 ºC ma wartość Kw = 25 ⋅ 10⁻¹⁴.
Oblicz pH wody w temperaturze 80 ºC. Wynik podaj z dokładnością do jednego miejsca po przecinku.
2. Poniżej zestawiono wartości iloczynu jonowego trzech rozpuszczalników w temperaturze 25ºC.
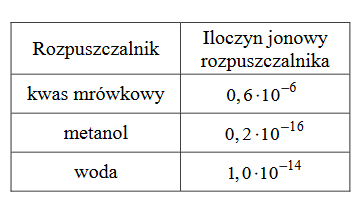
Uszereguj wymienione rozpuszczalniki według wzrastającego stopnia ich autoprotolizy w temperaturze 25 ºC. Napisz nazwy tych rozpuszczalników.
Liczba oktanowa – odporność benzyny na spalanie detonacyjne
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Liczba oktanowa LO określa odporność benzyny na spalanie detonacyjne, powodujące „stukanie” silnika spalinowego. Informuje ona, jaka zawartość procentowa (% objętościowy) 2,2,4-trimetylopentanu (izooktanu, LO = 100) w mieszaninie z heptanem (LO = 0) daje identyczną odporność na stukanie, jak dane paliwo. Liczba oktanowa rośnie, począwszy od alkanów o prostych łańcuchach węglowych, przez alkeny, cykloalkany, alkany o rozgałęzionych łańcuchach węglowych, aż do węglowodorów aromatycznych.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Benzynę można uzyskać w procesie krakingu frakcji ropy naftowej zawierających węglowodory o (wysokich / niskich) masach cząsteczkowych. Niską liczbę oktanową mają
benzyny zawierające głównie cząsteczki o (rozgałęzionych / nierozgałęzionych) łańcuchach. Im większa zawartość cząsteczek cyklicznych, tym (wyższa / niższa) liczba oktanowa benzyny.