Identyfikacja kationów glinu, potasu i magnezu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
W trzech probówkach I–III znajdują się rozmieszczone w przypadkowej kolejności wodne roztwory trzech soli: azotanu(V) glinu, azotanu(V) potasu i azotanu(V) magnezu. Te roztwory mają taką samą objętość V = 5 cm3 i jednakowe stężenie molowe
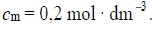
W celu zidentyfikowania zawartości probówek przeprowadzono dwuetapowe doświadczenie.
W etapie pierwszym do probówek dodano wodny roztwór wodorotlenku potasu.
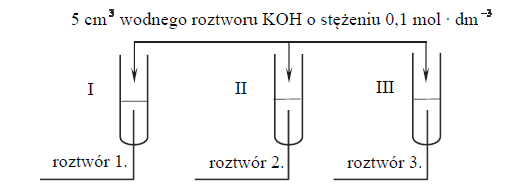
Po dodaniu niewielkiej ilości roztworu wodorotlenku potasu w probówkach I i II powstały białe osady, a w probówce III nie zaobserwowano objawów reakcji.
W etapie drugim doświadczenia do probówek z wytrąconymi osadami dodano kolejne porcje roztworu wodorotlenku potasu. Objawy reakcji zaobserwowano tylko w probówce II.
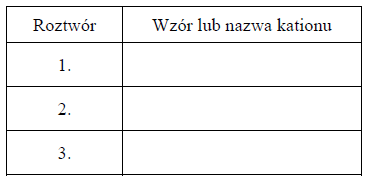
Zidentyfikuj kationy obecne w roztworach 1., 2. i 3. Wpisz ich wzory lub nazwy do tabeli.
Reakcje jonowe z kationami glinu, potasu i magnezu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
W trzech probówkach I–III znajdują się rozmieszczone w przypadkowej kolejności wodne roztwory trzech soli: azotanu(V) glinu, azotanu(V) potasu i azotanu(V) magnezu. Te roztwory mają taką samą objętość V = 5 cm3 i jednakowe stężenie molowe
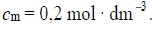
W celu zidentyfikowania zawartości probówek przeprowadzono dwuetapowe doświadczenie.
W etapie pierwszym do probówek dodano wodny roztwór wodorotlenku potasu.

Po dodaniu niewielkiej ilości roztworu wodorotlenku potasu w probówkach I i II powstały białe osady, a w probówce III nie zaobserwowano objawów reakcji.
W etapie drugim doświadczenia do probówek z wytrąconymi osadami dodano kolejne porcje roztworu wodorotlenku potasu. Objawy reakcji zaobserwowano tylko w probówce II.
Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas pierwszego etapu doświadczenia w probówce I.
Reakcje prowadzące do powstania jonów kompleksowych.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
W trzech probówkach I–III znajdują się rozmieszczone w przypadkowej kolejności wodne roztwory trzech soli: azotanu(V) glinu, azotanu(V) potasu i azotanu(V) magnezu. Te roztwory mają taką samą objętość V = 5 cm3 i jednakowe stężenie molowe
W celu zidentyfikowania zawartości probówek przeprowadzono dwuetapowe doświadczenie. W etapie pierwszym do probówek dodano wodny roztwór wodorotlenku potasu.

Po dodaniu niewielkiej ilości roztworu wodorotlenku potasu w probówkach I i II powstały białe osady, a w probówce III nie zaobserwowano objawów reakcji.
W etapie drugim doświadczenia do probówek z wytrąconymi osadami dodano kolejne porcje roztworu wodorotlenku potasu. Objawy reakcji zaobserwowano tylko w probówce II
Napisz w formie jonowej skróconej równanie reakcji zachodzącej w probówce II podczas drugiego etapu doświadczenia, jeżeli w tym procesie powstaje anion kompleksowy.
Redukcja manganianu(VII) potasu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Przeprowadzono doświadczenie, w którym do roztworu manganianu(VII) potasu dodano wodne roztwory substancji X i azotanu(III) sodu. Przebieg doświadczenia zilustrowano
poniższym schematem.
W czasie doświadczenia zaobserwowano zmianę barwy roztworu z fioletowej na zieloną.
Spośród wymienionych substancji wybierz wszystkie, które mogły zostać użyte jako substancja X w opisanym doświadczeniu. Podkreśl ich wzory.
NaCl
HCl
Ba(OH)2
H2SO4
NaOH
NH4Cl
NaNO3
Zmiana barwy manganianu(VII) potasu w czasie redukcji
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Przeprowadzono doświadczenie, w którym do roztworu manganianu(VII) potasu dodano wodne roztwory substancji X i azotanu(III) sodu. Przebieg doświadczenia zilustrowano
poniższym schematem.

W czasie doświadczenia zaobserwowano zmianę barwy roztworu z fioletowej na zieloną.
Spośród wymienionych substancji wybierz wszystkie, które mogły zostać użyte jako substancja X w opisanym doświadczeniu. Podkreśl ich wzory.
NaCl
HCl
Ba(OH)2
H2SO4
NaOH
NH4Cl
NaNO3
Ogniwo galwaiczne ołowiano magnezowe.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
W ogniwie galwanicznym zachodzi reakcja opisana równaniem:
Uzupełnij poniższy schemat ogniwa, w którym zachodzi opisana reakcja. Wpisz symbole metali i wzory jonów oraz zaznacz w tym ogniwie ładunki elektrod (+ albo –).
Oblicz SEM tego ogniwa w warunkach standardowych.
Płytka kadmowa w roztworze soli miedzi.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
W wodnym roztworze Cu(NO3)2 zanurzono płytkę kadmową o masie 75,0 g. Po pewnym czasie wyjęto ją, osuszono i zważono. Jej masa wynosiła 73,0 g. Stwierdzono, że w warunkach doświadczenia cały wydzielony metal osadził się na płytce.
Dokończ poniższe zdanie – wybierz i podkreśl właściwy opis spostrzeżenia spośród podanych w nawiasie.
Po zanurzeniu płytki kadmowej do wodnego roztworu Cu(NO3)2 zaobserwowano po dłuższym czasie, że barwa roztworu zmieniła się z (fioletowej na niebieską / bezbarwnej na zieloną / niebieskiej na bezbarwną).
Oblicz, ile gramów każdego z metali zawierała płytka po wyjęciu jej z roztworu. Przyjmij, że proces osadzania metalu na płytce zachodził z wydajnością równą 100%.
Sole miedzi(II), niklu(II) oraz srebra(I)
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
W 1 dm3 wody rozpuszczono sole miedzi(II), niklu(II) oraz srebra(I), zawierające identyczny anion. W otrzymanym roztworze stężenie molowe kationów wszystkich metali było jednakowe. Przez ten roztwór przepuszczono ładunek elektryczny w warunkach umożliwiających wydzielenie na katodzie kolejno trzech metali.
Uzupełnij poniższą tabelę – wpisz nazwy lub symbole metali w kolejności ich wydzielania na katodzie.
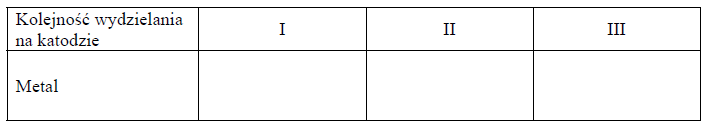
Wybierz i podkreśl nazwy wszystkich anionów, które mogłyby wchodzić w skład soli użytych w doświadczeniu, jeżeli proces prowadzono na elektrodach grafitowych, a na anodzie wydzielił się tylko bezbarwny i bezwonny gaz. Napisz równanie reakcji zachodzącej na anodzie.
Aniony:
azotany(V)
chlorki
siarczany(VI)
Równanie reakcji:
Elektroliza soli zawierającej kationy metalu X3+
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Podczas przepływu prądu o natężeniu 2 A przez wodny roztwór soli zawierającej jony metalu X3+ wydzieliło się 2,08 g tego metalu w ciągu 1,5 h. Stała Faradaya F = 96500 C · mol–1.
Oblicz masę molową metalu X. Przyjmij, że podczas elektrolizy nie zachodziły na katodzie inne procesy redukcji.
Izomeria geometryczna alkanów
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Przeprowadzono ciąg przemian opisany poniższym schematem.
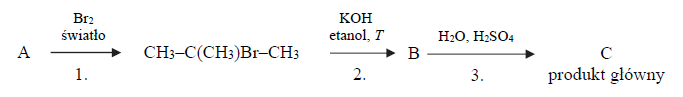
Organiczny produkt reakcji 1. ma jeden izomer o takim samym szkielecie węglowym.
Napisz nazwę systematyczną opisanego izomeru organicznego produktu reakcji 1.
Napisz równanie reakcji prowadzącej do otrzymania związku organicznego oznaczonego na schemacie literą B (reakcji 2. ) oraz równanie reakcji prowadzącej do otrzymania związku organicznego oznaczonego na schemacie literą C (głównego produktu reakcji 3.).
Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Równanie reakcji 2.:
Równanie reakcji 3.:
Typy i mechanizmy reakcji.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
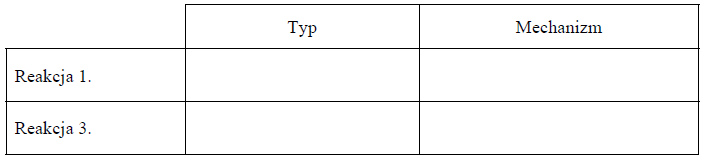
Przeprowadzono ciąg przemian opisany poniższym schematem.

Uzupełnij poniższą tabelę. Określ typ (addycja, eliminacja, substytucja) oraz mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji 1. i 3.
Redukcja manganianu poprzez cykloheksanol
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Cykloheksanol reaguje z manganianem(VII) potasu w środowisku kwasowym zgodnie z poniższym schematem.
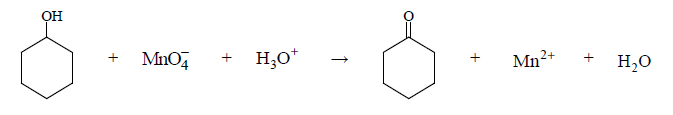
Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równania reakcji redukcji i utleniania zachodzących w czasie opisanej przemiany. Uwzględnij, że reakcja przebiega w środowisku kwasowym. Dobierz współczynniki stechiometryczne w poniższym schemacie.
Równanie reakcji redukcji:
Równanie reakcji utleniania:
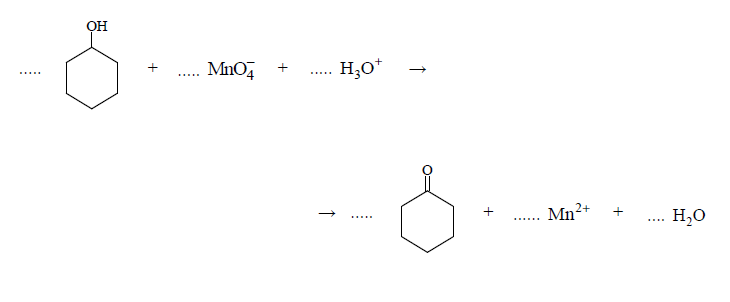
Entalpia spalenia acetylenu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Poniżej podano wartości standardowej entalpii spalania acetylenu i benzenu.
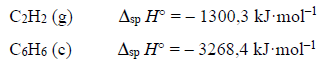
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Na podstawie powyższych danych oblicz entalpię ΔHo x reakcji trimeryzacji acetylenu, która zachodzi zgodnie z równaniem:
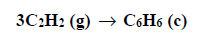
Alkohole o jednej i dwóch grupach hydroksylowych.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Do probówek, zawierających przygotowany wcześniej odczynnik, wprowadzono dwa różne związki: do probówki I – propan-2-ol, a do probówki II – propano-1,2-diol. Zawartość każdej probówki wymieszano. Objawy reakcji zaobserwowano tylko w jednej probówce.
Uzupełnij schemat doświadczenia. Wybierz i podkreśl nazwę użytego odczynnika.

Opisz zmiany możliwe do zaobserwowania po dodaniu propan-2-olu i propano-1,2-diolu do użytego odczynnika. Uwzględnij wygląd zawartości probówek przed reakcją i po dodaniu badanych związków.

Różnica w budowie alkoholi.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Do probówek, zawierających przygotowany wcześniej odczynnik, wprowadzono dwa różne związki: do probówki I – propan-2-ol, a do probówki II – propano-1,2-diol. Zawartość każdej probówki wymieszano. Objawy reakcji zaobserwowano tylko w jednej probówce.
Napisz, jaka różnica w budowie cząsteczek badanych alkoholi była przyczyną różnicy w przebiegu doświadczenia. Odnieś się do struktury cząsteczek obu związków.