Zdolność elektrolitu do dysocjacji zależy od właściwości tego elektrolitu oraz od właściwości użytego rozpuszczalnika.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Zdolność elektrolitu do dysocjacji zależy od właściwości tego elektrolitu oraz od właściwości użytego rozpuszczalnika. Im silniejszą zasadą Brønsteda jest rozpuszczalnik, tym w większym stopniu dysocjuje w nim elektrolit będący kwasem Brønsteda.
Zbadano dysocjację jednoprotonowego kwasu HA w różnych rozpuszczalnikach. W wodzie HA jest słabym kwasem.
Uzupełnij poniższe zdanie. Wybierz i zaznacz nazwę rozpuszczalnika.
W danej temperaturze wartość stałej dysocjacji kwasu HA jest największa w roztworze,
w którym rozpuszczalnikiem jest (ciekły amoniak / kwas mrówkowy / metanol / woda).
Gazowy chlorowodór można otrzymać w wyniku działania stężonego kwasu siarkowego(VI)…
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Gazowy chlorowodór można otrzymać w wyniku działania stężonego kwasu siarkowego(VI) na stałe chlorki, np. w reakcjach opisanych równaniami:
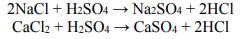
Sporządzono 150 g mieszaniny zawierającej tylko NaCl i CaCl2, na którą podziałano stężonym kwasem siarkowym(VI) użytym w nadmiarze. W wyniku tego procesu otrzymano 58,24 dm3 chlorowodoru (w warunkach normalnych).
Oblicz skład wyjściowej mieszaniny w procentach masowych. Przyjmij, że obie reakcje przebiegły z wydajnością równą 100%.
Przeprowadzono doświadczenie, w którym badano działanie pewnego odczynnika na dwa wodne roztwory soli.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Przeprowadzono doświadczenie, w którym badano działanie pewnego odczynnika na dwa
wodne roztwory soli. W probówce I znajdował się roztwór siarczanu(IV) sodu,
a w probówce II – roztwór krzemianu(IV) sodu. Po dodaniu odczynnika zaobserwowano, że:
• w każdej probówce zaszła reakcja chemiczna;
• przebieg doświadczenia był różny dla obu probówek;
• tylko w jednej z probówek wytrącił się osad.
Uzupełnij schemat doświadczenia. Wybierz i zaznacz w podanym zestawie wzór jednego odczynnika, którego zastosowanie spowodowało efekty opisane w informacji.
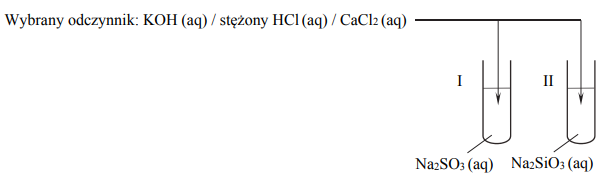
Napisz, co zaobserwowano w probówce, w której nie wytrącił się osad podczas opisanego doświadczenia.
Napisz w formie jonowej skróconej równania reakcji, które przebiegły w probówkach I i II i były przyczyną obserwowanych zmian.
Równanie reakcji przebiegającej w probówce I:
Równanie reakcji przebiegającej w probówce II:
Przeprowadzono doświadczenie, w którym do probówki I wlano kwas solnyo pH = 2, a do probówki II – wodny roztwór kwasu octowego (etanowego) o pH = 2.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Przeprowadzono doświadczenie, w którym do probówki I wlano kwas solny
o pH = 2, a do probówki II – wodny roztwór kwasu octowego (etanowego) o pH = 2. Roztwory miały temperaturę 298 K. Następnie do obu probówek dodano po 1 gramie pyłu cynkowego.
Opisane doświadczenie zilustrowano poniższym schematem.

Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

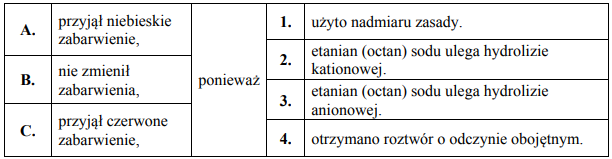
Do wodnego roztworu zawierającego 0,1 mola wodorotlenku sodu dodano wodny roztwórzawierający 0,1 mola kwasu etanowego (octowego).
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Do wodnego roztworu zawierającego 0,1 mola wodorotlenku sodu dodano wodny roztwór
zawierający 0,1 mola kwasu etanowego (octowego). Następnie w mieszaninie poreakcyjnej zanurzono żółty uniwersalny papierek wskaźnikowy.
Dokończ poniższe zdanie. Wybierz i zaznacz odpowiedź A, B albo C i jej uzasadnienie 1., 2., 3. albo 4.
Uniwersalny papierek wskaźnikowy
Jod otrzymuje się z saletry chilijskiej, zawierającej głównie azotan(V) sodu, lecz także m.in. śladowe ilości jodanu(V) sodu i jodanu(VII) sodu.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Jod otrzymuje się z saletry chilijskiej, zawierającej głównie azotan(V) sodu, lecz także m.in. śladowe ilości jodanu(V) sodu i jodanu(VII) sodu. Po zatężeniu wodnego roztworu jodany redukuje się do jodu za pomocą wodorosiarczanu(IV) sodu.
Na podstawie: J.D. Lee, Zwięzła chemia nieorganiczna, Warszawa, 1994.
Jedną z opisanych reakcji przedstawia poniższy schemat
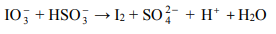
Napisz w formie jonowej skróconej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równania procesów redukcji i utleniania zachodzących podczas opisanej przemiany. Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.
Równanie procesu redukcji:
Równanie procesu utleniania:
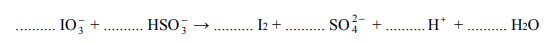
Jedną z metod otrzymywania halogenoalkanów jest reakcja alkoholu alifatycznegoz halogenkiem fosforu(III).
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Jedną z metod otrzymywania halogenoalkanów jest reakcja alkoholu alifatycznego
z halogenkiem fosforu(III). Ta reakcja przebiega zgodnie z poniższym schematem, w którym R oznacza grupę alkilową, a X – atom halogenu.
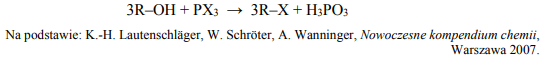
Napisz równanie reakcji otrzymywania 3-bromo-3-metyloheksanu opisaną metodą – zastosuj wzory półstrukturalne (grupowe) reagentów organicznych. Napisz nazwę systematyczną użytego alkoholu.

Nazwa systematyczna alkoholu:
Napisz wzór elektronowy bromku fosforu(III).
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Jedną z metod otrzymywania halogenoalkanów jest reakcja alkoholu alifatycznego
z halogenkiem fosforu(III). Ta reakcja przebiega zgodnie z poniższym schematem, w którym R oznacza grupę alkilową, a X – atom halogenu.
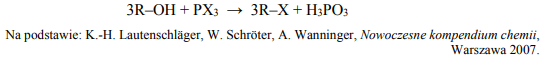
Napisz wzór elektronowy bromku fosforu(III). Pary elektronowe wiązań oraz wolne pary elektronowe zaznacz kreskami. Oceń, czy cząsteczka bromku fosforu(III) jest płaska.

Ocena:
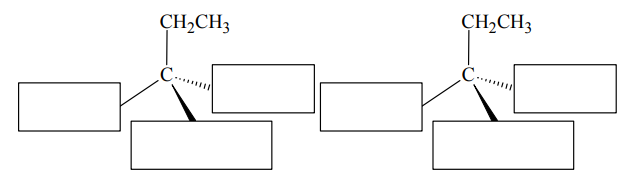
W opisanej metodzie 3-bromo-3-metyloheksan otrzymuje się w postaci mieszaninyracemicznej, czyli równomolowej mieszaniny obu enancjomerów.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Jedną z metod otrzymywania halogenoalkanów jest reakcja alkoholu alifatycznego
z halogenkiem fosforu(III). Ta reakcja przebiega zgodnie z poniższym schematem, w którym R oznacza grupę alkilową, a X – atom halogenu.
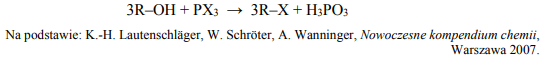
W opisanej metodzie 3-bromo-3-metyloheksan otrzymuje się w postaci mieszaniny
racemicznej, czyli równomolowej mieszaniny obu enancjomerów.
Uzupełnij poniższy schemat, tak aby przedstawiał wzory stereochemiczne składników tej mieszaniny.
Detergenty są składnikami powszechnie używanych środków czyszczących i piorących.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Detergenty są składnikami powszechnie używanych środków czyszczących i piorących. Wśród stosowanych obecnie detergentów można wyróżnić detergenty kationowe i anionowe.
Przykładem detergentu anionowego jest związek o wzorze
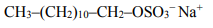
Można go otrzymać w reakcji estryfikacji z udziałem alkoholu o długim prostym łańcuchu
węglowym i odpowiedniego kwasu. Tak uzyskany ester poddaje się reakcji
z wodorotlenkiem sodu, w wyniku czego otrzymuje się środek powierzchniowo czynny, który – podobnie jak mydła – zawiera dwa fragmenty: niepolarny i polarny.
Podaj wzory sumaryczne alkoholu i kwasu nieorganicznego, których należy użyć w opisanym procesie otrzymania tego detergentu.
Wzór sumaryczny alkoholu:
Wzór sumaryczny kwasu nieorganicznego:
Alkanonitryle to związki o wzorze ogólnym R–CN, które otrzymuje się w reakcjiodpowiedniego halogenku alkilu z cyjankiem potasu o wzorze KCN.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Alkanonitryle to związki o wzorze ogólnym R–CN, które otrzymuje się w reakcji
odpowiedniego halogenku alkilu z cyjankiem potasu o wzorze KCN. Reakcja przebiega
w roztworze wodno-alkoholowym. W wyniku hydrolizy alkanonitryli w środowisku
rozcieńczonego kwasu siarkowego(VI) powstaje odpowiedni kwas karboksylowy.
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii,
Warszawa 2007.
Poniżej przedstawiono schemat ciągu reakcji, w wyniku których z alkanu I otrzymano alkan II:
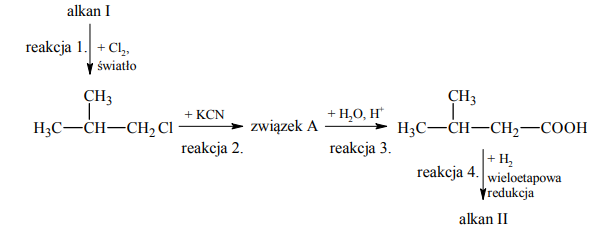
Napisz równanie reakcji 2. – zastosuj wzory półstrukturalne (grupowe) związków organicznych. Napisz nazwę systematyczną związku organicznego, który jest produktem reakcji 3.
Równanie reakcji 2.:
Nazwa systematyczna produktu reakcji 3.:
Napisz wzory półstrukturalne (grupowe) alkanów I i II.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Alkanonitryle to związki o wzorze ogólnym R–CN, które otrzymuje się w reakcji
odpowiedniego halogenku alkilu z cyjankiem potasu o wzorze KCN. Reakcja przebiega
w roztworze wodno-alkoholowym. W wyniku hydrolizy alkanonitryli w środowisku
rozcieńczonego kwasu siarkowego(VI) powstaje odpowiedni kwas karboksylowy.
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii,
Warszawa 2007.
Poniżej przedstawiono schemat ciągu reakcji, w wyniku których z alkanu I otrzymano alkan II:

Napisz wzory półstrukturalne (grupowe) alkanów I i II. Porównaj oba wzory i na tej podstawie określ, w jakim celu opisany proces (reakcje 1.–4.) jest stosowany w syntezie organicznej.
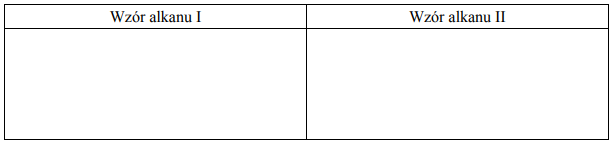
Zastosowanie opisanego procesu:
Mieszanina tlenku węgla(II) i wodoru to gaz syntezowy, który stosuje się do otrzymywania wielu związków organicznych.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Mieszanina tlenku węgla(II) i wodoru to gaz syntezowy, który stosuje się do otrzymywania wielu związków organicznych. Proces produkcji metanolu z gazu syntezowego zilustrowano poniższym równaniem.
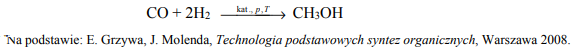
Oblicz, ile m3 gazu syntezowego odmierzonego w warunkach normalnych potrzeba do otrzymania 2 · 1025 cząsteczek metanolu, jeżeli reakcja przebiega z wydajnością równą 70%. Przyjmij, że stosunek molowy CO H2 n : n jest równy 1 : 2. Wynik zaokrąglij do jednego miejsca po przecinku.
Określ formalny stopień utlenienia oraz typ hybrydyzacji (sp, sp2, sp3) …
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Poniżej przedstawiono uproszczony wzór para-benzochinonu – jednego z chinonów – oraz produktu jego redukcji, czyli hydrochinonu. Pod wzorami tych związków podano ich nazwy systematyczne.
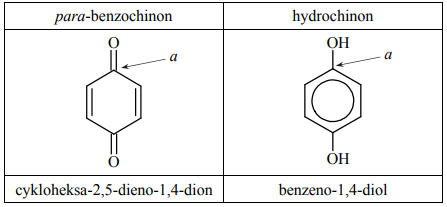
Izomerem para-benzochinonu jest orto-benzochinon. Jego nazwa systematyczna to
cykloheksa-3,5-dieno-1,2-dion.
Określ formalny stopień utlenienia oraz typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu węgla oznaczonego literą a w cząsteczce para-benzochinonu i w cząsteczce hydrochinonu. Uzupełnij tabelę.

Wybierz jedną parę odczynników, które umożliwią odróżnienie D-glukozy od D-tagatozy.
Arkusz maturalny z chemii rozszerzonej maj 2019 nowa formuła
Ketony, których cząsteczki zawierają grupę hydroksylową –OH przy atomie węgla połączonym z atomem węgla grupy karbonylowej (α-hydroksyketony), w wodnym roztworze o odczynie zasadowym ulegają izomeryzacji. Tę przemianę ilustruje poniższy schemat.
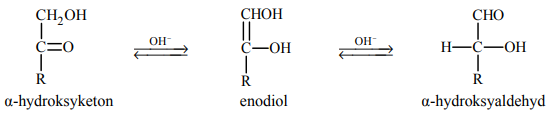

Wybierz jedną parę odczynników, które umożliwią odróżnienie D-glukozy od D-tagatozy. Uzupełnij schemat doświadczenia – podkreśl wzory wybranych odczynników.
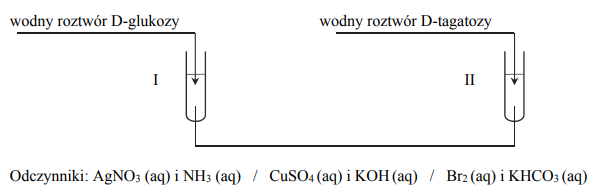
Opisz możliwe do zaobserwowania różnice w przebiegu doświadczenia dla obu monosacharydów – uzupełnij tabelę.

Wskaż różnicę w budowie cząsteczek D-glukozy i D-tagatozy umożliwiającą odróżnienie ich zaproponowaną metodą.