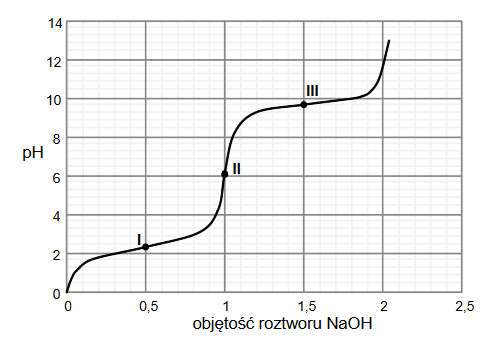
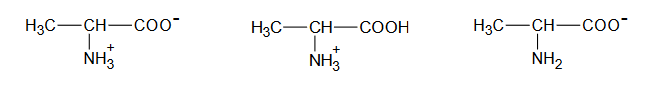
Reakcja hydratacji
Arkusz z chemii rozszerzonej maj 2023 stara formuła
Reakcję hydratacji (uwodnienia) etenu opisuje równanie:

Równowagowy stopień przereagowania etenu, który jest miarą wydajności przedstawionej reakcji, zależy od warunków prowadzenia procesu: temperatury i ciśnienia. Tę zależność przedstawiono na poniższym wykresie.
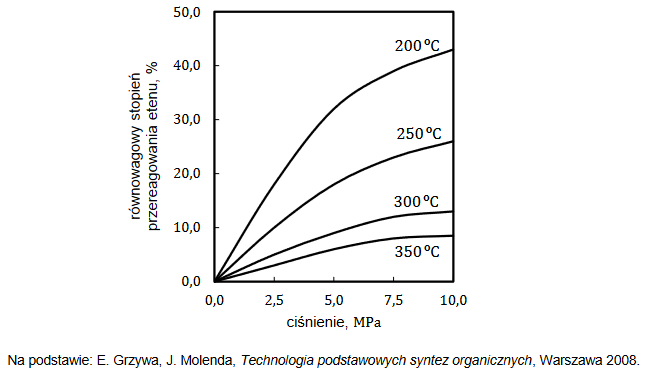
1. Wyjaśnij, dlaczego w danej temperaturze równowagowy stopień przereagowania etenu w opisanej reakcji jest tym większy, im wyższe jest ciśnienie, pod którym prowadzona jest reakcja.
2. Rozstrzygnij, czy reakcja hydratacji etenu jest procesem endo– czy egzotermicznym. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
reakcje stężonego kwasu azotowego(V) z metalami
Arkusz diagnostyczny z chemii 2022 grudzień
Badano reakcje stężonego kwasu azotowego(V) z metalami: z cynkiem, z glinem, z magnezem oraz ze srebrem. Jedno z przeprowadzonych doświadczeń pokazano na zdjęciu.

Wskaż metal, który znajduje się w probówce z kwasem pokazanej na zdjęciu, i uzasadnij swój wybór.
Symbol metalu:
Uzasadnienie:
Chlorek, bromek i jodek ołowiu(II) – sole trudno rozpuszczalne w wodzie
Arkusz diagnostyczny z chemii 2022 grudzień
Chlorek, bromek i jodek ołowiu(II) są solami trudno rozpuszczalnymi w wodzie. Chlorek i bromek mają barwę białą, a jodek jest żółty. Do 5,0 cm³ nasyconego roztworu chlorku ołowiu(II) dodano 2,5 cm³ roztworu pewnej soli i zaobserwowano efekt pokazany na zdjęciu.

Spośród poniższych soli wybierz tę, której roztwór mógł być użyty w tym doświadczeniu, i zaznacz jej wzór. Oblicz, jakie powinno być minimalne stężenie molowe użytego roztworu tej soli, żeby wystąpił zaobserwowany efekt.
NaCl
AgI
KBr
NaI
Pb(NO₃)₂
Minimalne stężenie molowe soli:
Systematyka związków nieorganicznych
Arkusz diagnostyczny z chemii 2022 grudzień
W celu skutecznego usunięcia jonów z roztworu stosuje się często metodę strąceniową, w której odczynnik strącający jest dodawany w nadmiarze.
Rozstrzygnij, czy w ten sposób można usunąć jony glinu z roztworu jego soli, gdy odczynnikiem strącającym będzie roztwór NaOH. Uzasadnij swoją odpowiedź.
Rozstrzygnięcie:
Uzasadnienie:
typowe właściwości chemiczne tlenków pierwiastków
Arkusz diagnostyczny z chemii 2022 grudzień
W trzech probówkach oznaczonych numerami 1, 2, 3, znajdowała się woda z dodatkiem oranżu metylowego. Do każdej z tych probówek wprowadzono małą porcję jednego z tlenków wybranych z poniższego zbioru:
Na₂O
SiO₂
P₄O₁₀
CuO
Zawartość każdej z probówek wymieszano i pozostawiono na pewien czas.

1. Uzupełnij tabelę. Wpisz wzory tlenków wprowadzonych do probówek 1 i 2.

2. Napisz w formie cząsteczkowej równanie reakcji, której produkt spowodował zmianę barwy oranżu metylowego w probówce 3.
kinetyka reakcji utleniania jonów bromkowych jonami bromianowymi(V)
Arkusz diagnostyczny z chemii 2022 grudzień
Badano kinetykę reakcji utleniania jonów bromkowych jonami bromianowymi(V) w środowisku kwasowym, która przebiega zgodnie z równaniem:
5Br⁻ + BrO₃⁻ + 6H+ → 3Br₂ + 3H₂O
Na podstawie pomiarów kinetycznych ustalono następującą zależność między szybkością tej
reakcji a stężeniami reagentów:
𝑣 = 𝑘 ⸱ [Br⁻] ⸱ [BrO₃⁻] ⸱ [H+]₂
1. Stała szybkości reakcji w zależności od postaci równania kinetycznego może mieć różny wymiar. Niżej przedstawiono przykładowe wyrażenia oznaczone literami A–D.
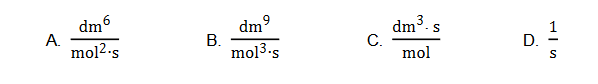
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych
w każdym nawiasie.
Stała szybkości reakcji utleniania jonów bromkowych jonami bromianowymi(V) ma jednostkę oznaczoną literą (A / B / C / D). Jedno z podanych wyrażeń nie może być jednostką stałej szybkości reakcji. To wyrażenie oznaczono literą (A / B / C / D).
2. Oblicz, jak zmieni się szybkość opisanej reakcji, jeżeli początkowe pH roztworu będzie wyższe o 𝟎, 𝟑.
gęstości wody bromowej i chloroformu
Arkusz diagnostyczny z chemii 2022 grudzień
Na zdjęciu obok pokazano dwuetapowe doświadczenie, podczas którego do probówki wprowadzono kilka cm³ chloroformu (CHCl₃) oraz wodę bromową (etap 1.), a następnie ciecze wymieszano i pozostawiono na pewien czas (etap 2.).

Przedstaw wniosek z pokazanego doświadczenia dotyczący porównania gęstości wody bromowej i chloroformu. Nazwij proces, który spowodował zmianę wyglądu zawartości probówki po wymieszaniu i ponownym rozdzieleniu się cieczy.
Gęstość chloroformu jest ? niż gęstość wody bromowej.
Nazwa procesu:
metody wykrywania obecności jonów bromkowych
Arkusz diagnostyczny z chemii 2022 grudzień
Jedna z metod wykrywania obecności jonów bromkowych albo jodkowych w roztworze polega na utlenieniu ich do wolnego bromu albo jodu.
Rozstrzygnij, czy zarówno jony bromkowe, jak i jony jodkowe można utlenić za pomocą kwasu azotowego(V). Uzasadnij swoją odpowiedź. W uzasadnieniu odnieś się do wartości odpowiednich potencjałów standardowych.
Rozstrzygnięcie:
– jony bromkowe:
– jony jodkowe:
Uzasadnienie:
reaktywność różnych metali
Materiały dodatkowe CKE 2022 - elektrochemia
W celu porównania reaktywności różnych metali wykonano doświadczenie, w którym płytkę z metalu M zważono i umieszczono w naczyniu zawierającym wodny roztwór pewnej soli. W wyniku zachodzącej reakcji roztwór się odbarwił. Płytkę wyjęto, opłukano wodą destylowaną, wysuszono i zważono ponownie. Ustalono, że w wyniku reakcji masa płytki zmalała.
1. Wybierz i podkreśl jeden symbol metalu w zestawie I i jeden wzór odczynnika w zestawie II, tak aby otrzymać schemat przeprowadzonego doświadczenia.

2. Napisz w formie jonowej skróconej równanie reakcji, która zaszła podczas doświadczenia.
reakcja w ogniwie zbudowanym z dwóch półogniw
MATERIAŁY DODATKOWE CKE 2022 - ELEKTROCHEMIA
W pewnym ogniwie zbudowanym z dwóch półogniw metalicznych zachodzi reakcja zilustrowana równaniem:
2Cr + 3Sn²⁺ → 2Cr³⁺ + 3Sn
Przedstaw zgodnie z konwencją sztokholmską schemat opisanego ogniwa.
przewidywanie kierunku przebiegu reakcji utleniania-redukcji
MATERIAŁY DODATKOWE CKE 2022 - ELEKTROCHEMIA
W poniższej tabeli przedstawiono równania reakcji redukcji jonów wybranych metali oraz wartości potencjałów standardowych dla wymienionych par redoks.
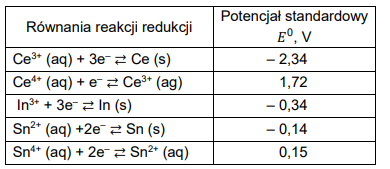
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.