woda chlorowa – roztwór wodny chloru
Arkusz z chemii rozszerzonej czerwiec 2021
Roztwór wodny chloru to tzw. woda chlorowa Cl₂(aq). W tym roztworze ustala się równowaga opisana równaniem:
Cl₂ + H2O ⇄ HCl + HClO
Powstający oksokwas pod wpływem światła ulega częściowemu rozkładowi z wydzieleniem tlenu:
2HClO → 2HCl + O₂
10,65 g chloru rozpuszczono w 1800 cm³ wody, a otrzymaną wodę chlorową pozostawiono na pewien czas w otwartym naczyniu na świetle.
Oblicz stężenie molowe kwasu solnego w roztworze w momencie, w którym 1,0% chloru obecnego w roztworze uległ reakcji chemicznej z wodą, a oksokwas powstający w roztworze uległ w 50% reakcji rozkładu. W obliczeniach przyjmij, że sumaryczna objętość roztworu się nie zmieniła i wynosiła 1800 cm³.
.
reakcje zachodzące w roztworach wodnych
Arkusz z chemii rozszerzonej czerwiec 2021
Do 50 cm3 wodnego roztworu CuSO4 o stężeniu 0,4 mol ∙ dm −3 wprowadzono 783 mg opiłków pewnego metalu X, który reagował z jonami Cu +2 w stosunku molowym 1 : 1. Metal X w szeregu napięciowym metali jest przed kadmem. Po zakończeniu reakcji do otrzymanej mieszaniny dodano 1200 mg opiłków kadmu i wtedy reakcja przebiegała dalej, do całkowitego odbarwienia roztworu. Kadm reagował z jonami Cu +2 w stosunku molowym 1 : 1. Po zakończeniu reakcji, wydzielono z jej produktów mieszaninę metali i stwierdzono, że zawiera ona 19% masowych kadmu.
Oblicz masę molową metalu X i podaj jego symbol chemiczny. Przyjmij, że masy molowe są równe: MCu = 63,55 g ∙ mol−1, MCd = 112,41 g ∙ mol−1.
reakcje zachodzące w roztworach wodnych
Arkusz z chemii rozszerzonej maj 2021
Przeprowadzono ciąg przemian chemicznych przedstawiony na poniższym schemacie.
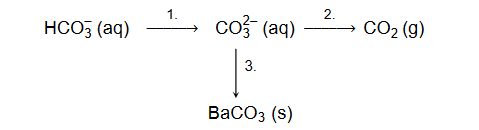
1. Spośród wymienionych odczynników
● wodorotlenek potasu
● kwas etanowy
● siarczan(VI) baru
● azotan(V) baru
wybierz i wpisz do tabeli nazwy lub wzory tych substancji, które mogły być użyte w poszczególnych etapach opisanego schematem ciągu przemian.
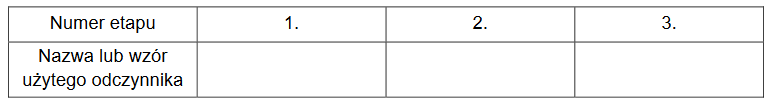
2. Napisz w formie jonowej skróconej równania reakcji oznaczonych na schemacie numerami 1. i 2.
Równanie reakcji 1.:
Równanie reakcji 2.:
Roztwory i reakcje zachodzące w roztworach wodnych
Arkusz z chemii rozszerzonej maj 2021
Do 20 cm3 wodnego roztworu HCl o pH = 1,0 dodano 30 cm³ wodnego roztworu NaOH o stężeniu 0,060 mol∙dm⁻³. Po zmieszaniu roztworów przebiegła reakcja chemiczna opisana
równaniem:
H3O⁺ + OH⁻ → 2H₂O
Wykonaj odpowiednie obliczenia i napisz, ile razy zmalało stężenie jonów hydroniowych H3O⁺ po dodaniu roztworu NaOH. Przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów.
Kinetyka i statyka chemiczna
Arkusz z chemii rozszerzonej maj 2021
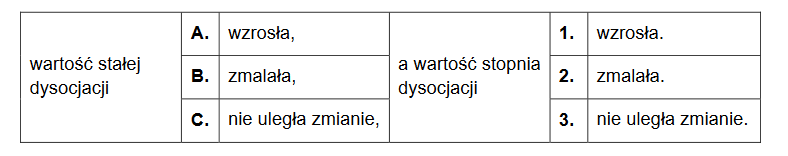
Do 500 cm³ wodnego roztworu kwasu metanowego (mrówkowego) o stężeniu 1 mol ∙ dm⁻³ dodano 500 cm³ wody. Temperatura otrzymanego roztworu nie uległa zmianie.
Dokończ zdanie. Zaznacz odpowiedź wybraną spośród A–C oraz odpowiedź wybraną spośród 1.–3.
Należy wnioskować, że po dodaniu wody do wodnego roztworu kwasu metanowego
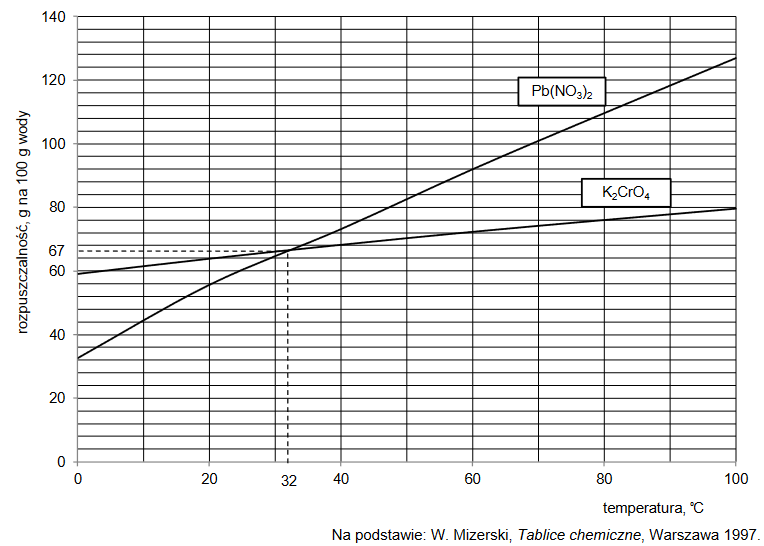
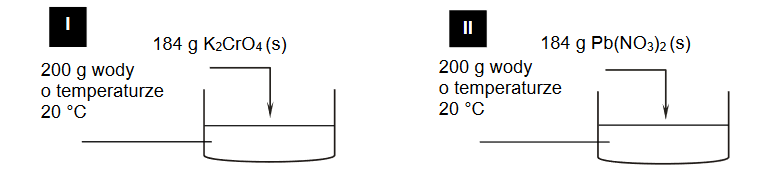
Sacharoza – cukier dobrze rozpuszczalny w wodzie
Arkusz z chemii rozszerzonej marzec 2021
Sacharoza dobrze rozpuszcza się w wodzie, a jej rozpuszczalność w dużym stopniu zależy od temperatury.
Przygotowano nasycony wodny roztwór sacharozy w temperaturze 80 °C. Następnie ochłodzono go do temperatury 20 °C i stwierdzono, że wykrystalizowało 1590 g sacharozy, a roztwór, który pozostał po krystalizacji, miał masę 3040 g.
Oblicz rozpuszczalność sacharozy (w gramach na 100 gramów wody) w temperaturze 80 °C, jeśli w temperaturze 20 °C jest ona równa 204 g na 100 g wody.
interpretacja wartości stałej dysocjacji, pH, pKw
Arkusz z chemii rozszerzonej marzec 2021
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm⁻³.
1. Napisz wzory sumaryczne tych soli w kolejności wzrastającego pH ich wodnych roztworów.
2. Napisz w formie jonowej skróconej równanie reakcji zachodzącej w roztworze chlorku amonu.
3. Określ, jaką funkcję (kwasu czy zasady Brønsteda) pełni woda w reakcji zachodzącej w roztworze fluorku sodu.
Przygotowywanie i rozcieńczanie roztworów
Arkusz z chemii rozszerzonej marzec 2021
Odmierzono 10,0 cm³ kwasu solnego o stężeniu c = 10,0% masowych i gęstości d = 1,05 g · cm⁻³ , a następnie rozcieńczono ten kwas wodą destylowaną do objętości 750 cm³ .
Oblicz pH otrzymanego roztworu. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
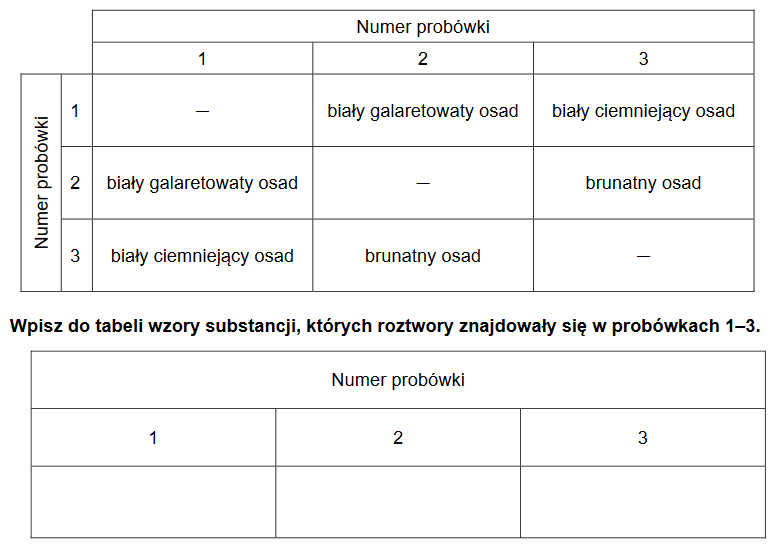
otrzymywanie wodorotlenków i soli różnymi metodami
Arkusz z chemii rozszerzonej marzec 2021
W trzech ponumerowanych probówkach znajdowały się bezbarwne wodne roztwory: azotanu(V) srebra(I), chlorku glinu i wodorotlenku potasu. Roztwory mieszano ze sobą, a obserwacje z przeprowadzonych doświadczeń przedstawiono w poniższej tabeli.