zasady rozmieszczania elektronów na orbitalach
Arkusz diagnostyczny z chemii 2022 grudzień
Na zdjęciu obok przedstawiono wodny roztwór soli, w skład której wchodzą pierwiastki X1, X2 i X3. Dwa z nich są w stanie wolnym metalami i należą do tego samego okresu, a jeden jest niemetalem i leży w innym okresie. Masy atomowe tych trzech pierwiastków, zaokrąglone do liczb całkowitych, spełniają zależność: M X1 + M X2 = M X3. Atom pierwiastka X3 ma na zewnętrznej powłoce dwa razy więcej elektronów niż atom pierwiastka X2, a atom pierwiastka X1 ma na zewnętrznej powłoce dwa razy więcej niesparowanych elektronów niż atom pierwiastka X2.

1. Zidentyfikuj pierwiastki X1, X2 oraz X3. Napisz ich symbole chemiczne.
X1:
X2:
X3:
2. Uzupełnij poniższą tabelę. Wpisz wartości liczb kwantowych odpowiadających niesparowanym elektronom w atomach (w stanie podstawowym) pierwiastków X1 i X3.

masa atomowa, a liczba masowa
Arkusz diagnostyczny z chemii 2022 grudzień
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.

konfiguracje elektronowe atomów pierwiastków
Arkusz diagnostyczny z chemii 2022 grudzień
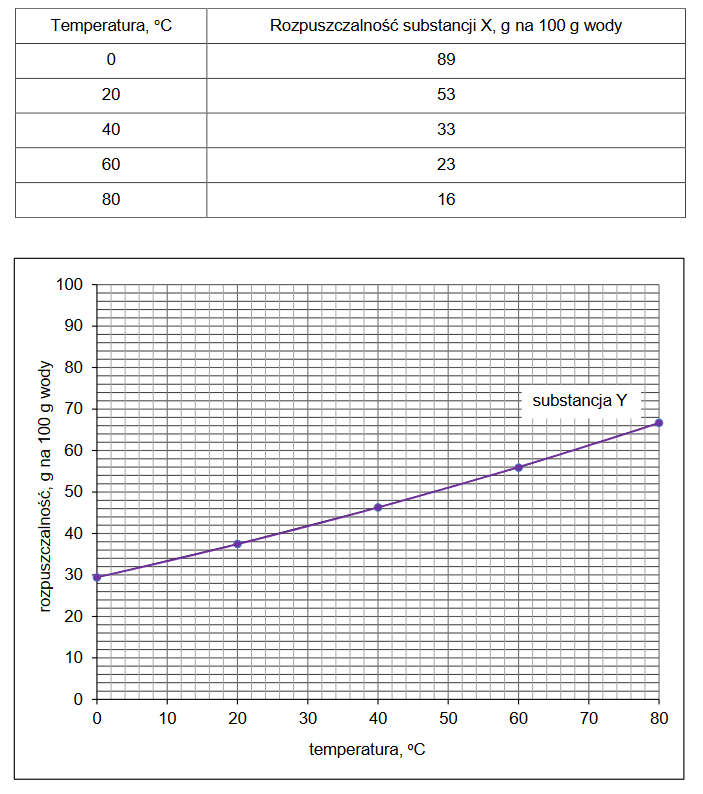
Niżej przedstawiono konfigurację elektronową kationu pewnego pierwiastka o ładunku 3+.
1s² 2s² 2p⁶ 3s² 3p⁶ 3d³
Wpisz symbol tego pierwiastka w miejscu na to przeznaczonym oraz uzupełnij poniższy schemat tak, aby przedstawiał konfigurację elektronową jego atomu w stanie podstawowym.
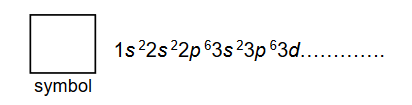
wiązania chemiczne i oddziaływania międzycząsteczkowe
Arkusz diagnostyczny z chemii 2022 grudzień
Niżej wymieniono wybrane wiązania chemiczne i oddziaływania międzycząsteczkowe, którym przyporządkowano numery od 1 do 6.
Porównaj dwa układy: stały azotan(V) potasu i rozcieńczony wodny roztwór tej soli, pod względem występujących w nich wiązań chemicznych i oddziaływań międzycząsteczkowych. Wpisz właściwe numery w odpowiednie kolumny tabeli. Uwzględnij wszystkie wiązania i oddziaływania występujące w każdym z tych układów.

substancje tworzące kryształy
Arkusz diagnostyczny z chemii 2022 grudzień
Dwie substancje oznaczono umownie literami A i B. W poniższej tabeli przedstawiono podobieństwa i różnice we właściwościach tych substancji.
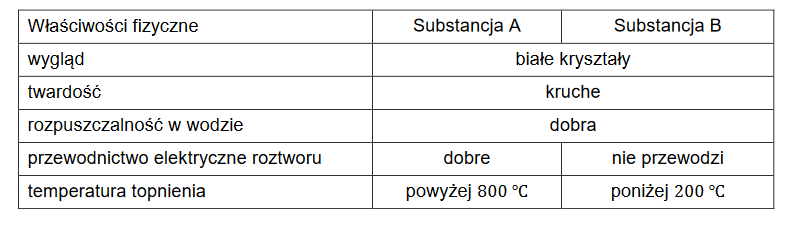
Określ rodzaje kryształów (metaliczne, jonowe, kowalencyjne, molekularne) tworzone przez badane substancje.

pojęcie standardowej entalpii przemiany
Arkusz diagnostyczny z chemii 2022 grudzień
Rozstrzygnij, czy na podstawie wartości entalpii tworzenia CO oraz CO2 można stwierdzić, że reakcja spalania tlenku węgla(II) jest egzotermiczna. Uzasadnij swoją odpowiedź.
Rozstrzygnięcie:
Uzasadnienie:
interpretacja jakościowa i ilościowa równania reakcji
Arkusz diagnostyczny z chemii 2022 grudzień
Przygotowano dwa zestawy laboratoryjne umożliwiające pomiar objętości gazu wydzielonego w reakcji metali z kwasem solnym. W kolbie jednego zestawu umieszczono próbkę mieszaniny wiórków magnezu i miedzi w stosunku molowym 8 : 3, a w kolbie drugiego zestawu – próbkę o takiej samej masie, ale złożoną z wiórków glinu i srebra. Do kolb wprowadzono nadmiar kwasu solnego i stwierdzono, że objętość wydzielonego gazu była taka sama w obu zestawach.
Oblicz zawartość glinu w % masowych w mieszaninie wiórków użytej w doświadczeniu. Przyjmij wartości mas molowych:
MMg = 24 g∙mol⁻¹,
MCu = 64 g∙mol⁻¹,
MAl = 27 g∙mol⁻¹,
MAg = 108 g∙mol⁻¹.
reakcje stężonego kwasu azotowego(V) z metalami
Arkusz diagnostyczny z chemii 2022 grudzień
Badano reakcje stężonego kwasu azotowego(V) z metalami: z cynkiem, z glinem, z magnezem oraz ze srebrem. Jedno z przeprowadzonych doświadczeń pokazano na zdjęciu.

Wskaż metal, który znajduje się w probówce z kwasem pokazanej na zdjęciu, i uzasadnij swój wybór.
Symbol metalu:
Uzasadnienie:
Chlorek, bromek i jodek ołowiu(II) – sole trudno rozpuszczalne w wodzie
Arkusz diagnostyczny z chemii 2022 grudzień
Chlorek, bromek i jodek ołowiu(II) są solami trudno rozpuszczalnymi w wodzie. Chlorek i bromek mają barwę białą, a jodek jest żółty. Do 5,0 cm³ nasyconego roztworu chlorku ołowiu(II) dodano 2,5 cm³ roztworu pewnej soli i zaobserwowano efekt pokazany na zdjęciu.

Spośród poniższych soli wybierz tę, której roztwór mógł być użyty w tym doświadczeniu, i zaznacz jej wzór. Oblicz, jakie powinno być minimalne stężenie molowe użytego roztworu tej soli, żeby wystąpił zaobserwowany efekt.
NaCl
AgI
KBr
NaI
Pb(NO₃)₂
Minimalne stężenie molowe soli:
Systematyka związków nieorganicznych
Arkusz diagnostyczny z chemii 2022 grudzień
W celu skutecznego usunięcia jonów z roztworu stosuje się często metodę strąceniową, w której odczynnik strącający jest dodawany w nadmiarze.
Rozstrzygnij, czy w ten sposób można usunąć jony glinu z roztworu jego soli, gdy odczynnikiem strącającym będzie roztwór NaOH. Uzasadnij swoją odpowiedź.
Rozstrzygnięcie:
Uzasadnienie:
typowe właściwości chemiczne tlenków pierwiastków
Arkusz diagnostyczny z chemii 2022 grudzień
W trzech probówkach oznaczonych numerami 1, 2, 3, znajdowała się woda z dodatkiem oranżu metylowego. Do każdej z tych probówek wprowadzono małą porcję jednego z tlenków wybranych z poniższego zbioru:
Na₂O
SiO₂
P₄O₁₀
CuO
Zawartość każdej z probówek wymieszano i pozostawiono na pewien czas.

1. Uzupełnij tabelę. Wpisz wzory tlenków wprowadzonych do probówek 1 i 2.

2. Napisz w formie cząsteczkowej równanie reakcji, której produkt spowodował zmianę barwy oranżu metylowego w probówce 3.
stan równowagi dynamicznej i stała równowagi
Arkusz diagnostyczny z chemii 2022 grudzień
W wysokiej temperaturze tlenki żelaza można zredukować wodorem do metalicznego żelaza. Redukcja tlenku Fe₃O₄ przebiega zgodnie z równaniem:
Fe₃O₄(s) + 4H₂(g) ⇄ 3Fe(s) + 4H₂O(g)
Z reaktora o pojemności 8,0 dm3, zawierającego 420 g tlenku Fe₃O₄, odpompowano powietrze i wprowadzono 6,0 g wodoru. Zawartość reaktora ogrzano do temperatury 𝑇, w której stała równowagi powyższej reakcji wynosi 0,20.
Oblicz stężenie pary wodnej w reaktorze po ustaleniu się stanu równowagi oraz masę otrzymanego żelaza.