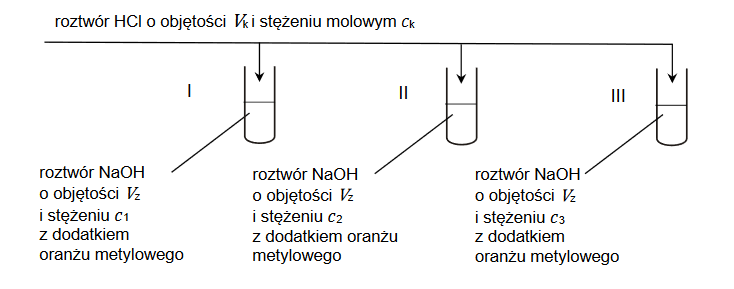
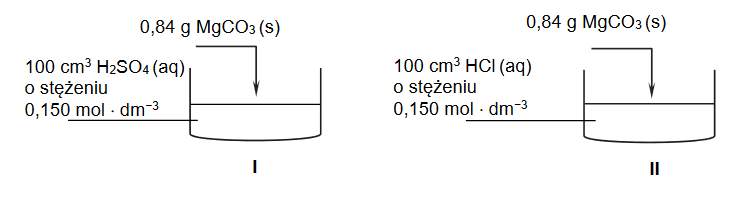
Identyfikacja pierwiastków chemicznych
Arkusz z chemii rozszerzonej czerwiec 2021
Zidentyfikuj pierwiastki chemiczne na podstawie podanych niżej opisów konfiguracji atomów lub jonów w stanie podstawowym. Wpisz ich symbole do tabeli.

identyfikacja pierwiastków chemicznych
Arkusz z chemii rozszerzonej czerwiec 2021
Poniżej przedstawiono wzory elektronowe cząsteczek dwóch pierwiastków, oznaczonych umownie literami A i D. Oba pierwiastki należą do drugiego okresu układu okresowego.

Zidentyfikuj pierwiastki A i D, a następnie uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Większy ładunek jądra ma atom pierwiastka oznaczonego literą (A / D). Mniejszy promień atomowy ma atom pierwiastka oznaczonego literą (A / D).
Atomy i cząsteczki chemiczna
Arkusz z chemii rozszerzonej czerwiec 2021
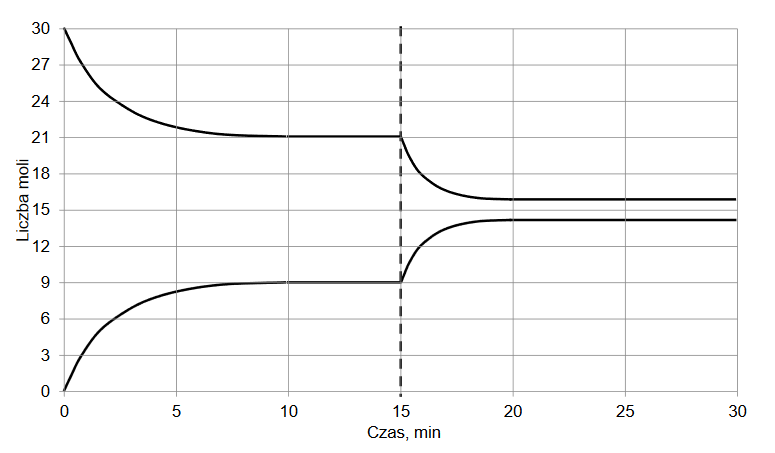
W zamkniętym zbiorniku znajdowała się pewna ilość NO 2. W temperaturze 800 K gaz ulegał rozkładowi zgodnie z równaniem:
2NO2 (g) ⇄ 2NO (g) + O 2 (g) ∆H > 0
Po ustaleniu się stanu równowagi w naczyniu znajdowało się 90 g tlenku azotu(II). Wydajność rozkładu NO 2 wyniosła 60%.
Określ:
• stosunek molowy tlenków azotu w zbiorniku w stanie równowagi;
• liczbę moli tlenu w zbiorniku w stanie równowagi;
• masę tlenku azotu(IV) wprowadzonego do zbiornika przed zainicjowaniem reakcji – w gramach.
Stosunek molowy n 2NO : n NO =
Liczba moli tlenu n 2O =
Masa tlenku azotu(IV) przed zainicjowaniem reakcji m 2NO =
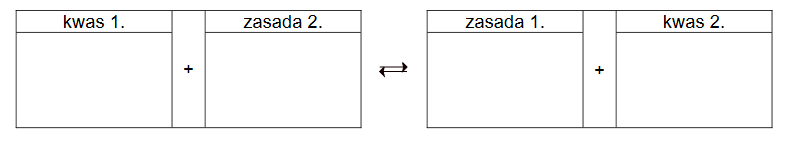
woda chlorowa – roztwór wodny chloru
Arkusz z chemii rozszerzonej czerwiec 2021
Roztwór wodny chloru to tzw. woda chlorowa Cl₂(aq). W tym roztworze ustala się równowaga opisana równaniem:
Cl₂ + H2O ⇄ HCl + HClO
Powstający oksokwas pod wpływem światła ulega częściowemu rozkładowi z wydzieleniem tlenu:
2HClO → 2HCl + O₂
10,65 g chloru rozpuszczono w 1800 cm³ wody, a otrzymaną wodę chlorową pozostawiono na pewien czas w otwartym naczyniu na świetle.
Oblicz stężenie molowe kwasu solnego w roztworze w momencie, w którym 1,0% chloru obecnego w roztworze uległ reakcji chemicznej z wodą, a oksokwas powstający w roztworze uległ w 50% reakcji rozkładu. W obliczeniach przyjmij, że sumaryczna objętość roztworu się nie zmieniła i wynosiła 1800 cm³.
.
reakcje zachodzące w roztworach wodnych
Arkusz z chemii rozszerzonej czerwiec 2021
Do 50 cm3 wodnego roztworu CuSO4 o stężeniu 0,4 mol ∙ dm −3 wprowadzono 783 mg opiłków pewnego metalu X, który reagował z jonami Cu +2 w stosunku molowym 1 : 1. Metal X w szeregu napięciowym metali jest przed kadmem. Po zakończeniu reakcji do otrzymanej mieszaniny dodano 1200 mg opiłków kadmu i wtedy reakcja przebiegała dalej, do całkowitego odbarwienia roztworu. Kadm reagował z jonami Cu +2 w stosunku molowym 1 : 1. Po zakończeniu reakcji, wydzielono z jej produktów mieszaninę metali i stwierdzono, że zawiera ona 19% masowych kadmu.
Oblicz masę molową metalu X i podaj jego symbol chemiczny. Przyjmij, że masy molowe są równe: MCu = 63,55 g ∙ mol−1, MCd = 112,41 g ∙ mol−1.
porównanie aktywności chemicznej metali
Arkusz z chemii rozszerzonej czerwiec 2021
Przeprowadzono doświadczenie zgodnie z poniższym schematem.
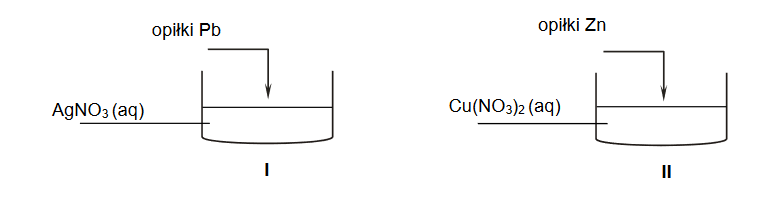
1. Napisz w formie jonowej skróconej równanie reakcji zachodzącej po dodaniu opiłków ołowiu do zlewki I. Rozstrzygnij, czy po zakończeniu doświadczenia masa roztworu w zlewce I wzrosła czy zmalała. Odpowiedź uzasadnij.
Równanie zachodzącej reakcji:
Rozstrzygnięcie:
Uzasadnienie:
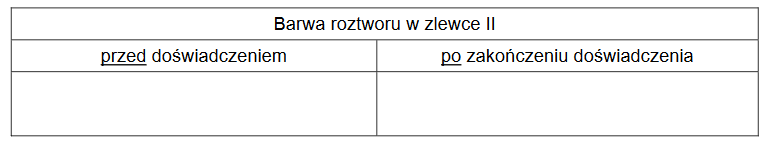
2. Po zakończeniu doświadczenia na dnie zlewki II znajdowały się dwa metale: cynk oraz miedź. Uzupełnij poniższą tabelę. Napisz, jaką barwę miał roztwór w probówce II przed reakcją i po jej zakończeniu.
obliczenia dotyczące mas substratów i produktów
Arkusz z chemii rozszerzonej czerwiec 2021
Próbkę mieszaniny NaCl i MgCl₂ o masie 3,7 g rozpuszczono w wodzie, a do otrzymanej mieszaniny dodano nadmiar wodnego roztworu AgNO₃. W roztworze zaszła reakcja opisana równaniem:
Ag⁺ + Cl⁻ → AgCl↓
Odsączony, przemyty i wysuszony osad AgCl ważył 10,0 g.
Oblicz masę chlorku magnezu w próbce mieszaniny. Wynik podaj w gramach i zaokrąglij do jednego miejsca po przecinku.